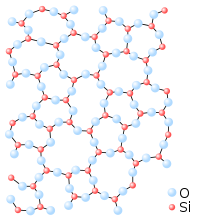
شبه البلورة (Quasicrystal) هي شكل منتظم وغير دوري (nonperiodic). وهي تشكل أنماطا تغطي كل الحيز دون فراغات ولكنها تفتقر إلى التماثل الانتقالي (translational symmetry). النظرية الكلاسيكية للبلورات يسمح فقط ب 2 و 3 و 4 و 6 مرات من التناظر الدوراني (rotational symmetries)، ولكن شبه البلورة تظهر درجات أكبر من التماثل (الطيات). يمكن أن تكون في حالة وسطية بين الكريستال والزجاج. مثل البلورات, شبه البلورة تنتج حيودا (diffraction) رائعا. بينما بنية البلورات لها تكرار بسيط, شبه البلورات هي أكثر تعقيدا.
إجمالي مرات مشاهدة الصفحة
الجمعة، 8 فبراير 2013
مادة لابلورية
من ويكيبيديا، الموسوعة الحرة
أشهر أنواع المواد اللابلورية الزجاج وتسمى تلك المواد أحيانا "سائل صلب" حيث أن الجزيئات في السائل تكون موزعة عشوائيا بلا نظام ، كما توصف المواد اللابلورية بأنها "زجاجية البنية " .
[عدل] مثال لمادة بلورية
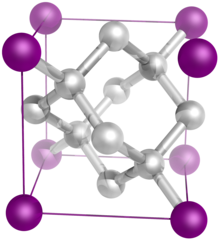
وحدة خلية الحديدالشكل المقابل يبين وحدة خلية الحديد من النوع ألفا-الحديد ، وهو نظام بلوري مكعب . ولكي نقوم بتعيين عدد الذرات الموجودة في الخلية ، فنهدها كالآتي:
- توجد ثمانية ذرات تشغل الثمانية أركان للمكعب . ولكن كل منها يشترك في ثمانية مكعبات مجاورة ، فيكون نصيب خليتنا منها ذرة واحدة .
- تحتوي خليتنا على ذرة في مركزها .
لذلك يسمى هذا النظام المكعب نظام بلوري مكعب مركزي الجسم
انفلاق بلوري
من ويكيبيديا، الموسوعة الحرة
انفلاق بلوري في علم المعادن (بالإنجليزية: Cleavage ) هي خاصية بعض البلورات المعدنية للانفلاق أو الانقسام عبر مستويات معينة للبلورة تحت تأثير قوة بسيطة عليها موازية للمستوي. تتميز تلك المستويات بشدة تماسك بينية ضعيفة وترتيب الذرات أو الأيونات بانتظام في البلورة . يمكن رؤية تلك الطبقات بالمجهر وأيضا بالعين المجردة . [1]
[عدل] بعض أنواع الانفلاق البلوري
ماء التبلور
من ويكيبيديا، الموسوعة الحرة
ماء التبلور هو الماء الذي يتواجد في البلورات، ولكنه لا يرتبط تساهمياً مع الجزئية أو الأيون المضيف. عندما يوحد ماء التبلور في البنية البلورية للمركب الكيميائي بسمى حينئذ بالهيدرات.
يتفاوت عدد جزيئات الماء الداخلة في ماء التبلور وذلك حسب طبيعة المركب الكيميائي. يبين الجدول التالي الأنواع المختلفة من الهيدرات.
يتفاوت عدد جزيئات الماء الداخلة في ماء التبلور وذلك حسب طبيعة المركب الكيميائي. يبين الجدول التالي الأنواع المختلفة من الهيدرات.
| الاسم | عدد جزيئات الماء | أمثلة من أملاح | أمثلة من مركبات أخرى |
|---|---|---|---|
| لامائي | 0 | كلوريد المغنسيوم-اللامائي | |
| نصف هيدرات | 1/2 | كبريتات الكالسيوم-نصف هيدرات | |
| أحادي هيدرات | 1 | بيكبريتات الصوديوم-أحادي هيدرات | حمض الليمون-أحادي هيدرات،غلوكوز-أحادي هيدرات |
| واحد ونصف هيدرات | 1,5 | كربونات البوتاسيوم-واحد ونصف هيدرات | |
| ثنائي هيدرات | 2 | كبريتات الكالسيوم-ثنائي هيدرات ،كلوريد الكالسيوم-ثنائي هيدرات | |
| ثلاثي هيدرات | 3 | خلات الصوديوم-ثلاثي هيدرات ،خلات الرصاص الثنائي-ثلاثي هيدرات | |
| رباعي هيدرات | 4 | طرطرات صوديوم وبوتاسيوم-رباعي هيدرات | |
| خماسي هيدرات | 5 | كبريتات النحاس الثنائي-خماسي هيدرات | |
| سداسي هيدرات | 6 | كلوريد الألومنيوم-سداسي هيدرات ،كلوريد الكوبالت الثنائي-سداسي هيدرات | |
| سباعي هيدرات | 7 | كبريتات المغنسيوم-سباعي هيدرات ،كبريتات الحديد الثنائي-سباعي هيدرات ،كبريتات الزنك-سباعي هيدرات | |
| ثماني هيدرات | 8 | هيدروكسيد الباريوم-ثماني هيدرات | |
| تساعي هيدرات | 9 | نترات الكروم الثلاثي-تساعي هيدرات | |
| عشاري هيدرات | 10 | كبريتات الصوديوم-عشاري هيدرات(ملح غلاوبر)،كربونات الصوديوم-عشاري هيدرات | |
| إحدى عشري هيدرات | 11 | ||
| اثنا عشري هيدرات | 12 | فوسفات ثلاثي الصوديوم-اثنا عشري هيدرات |
نظام بلوري
من ويكيبيديا، الموسوعة الحرة
- نظام بلوري مكعب
- نظام بلوري رباعي
- نظام بلوري سداسي
- نظام بلوري ثلاثي
- نظام بلوري معيني مستقيم
- نظام بلوري أحادي الميل
- نظام بلوري ثلاثي الميل
يلاحظ تناوب شغل الزوايا : أيون صوديوم (أحمر) يجاوره أيون كلور (أخضر) يجاوره أيون صوديوم يجاوره أيون كلور ... وهكذا ، وذلك سواء نظرنا إلى البلورة من اليمين إلا اليسار ، أو من أعلى إلى أسفل ، أو من الأمام إلى الخلف . فالتبلور عملية منتظمة.
دراسة البلورات بالأشعة السينية
دراسة البلورات بالأشعة السينية (بالإنجليزية: X-ray crystallography) هي أسلوب لمعرفة ترتيب الذرات داخل البلورات، حيث تضرب أشعة سينية البلورة فتحيد نحو عدّة اتجاهات معيّنة. ويتنج دارس البلورات - بناء على زوايا وشدة تلك الأشعات المنحرفة - صورة ثلاثية الأبعاد لكثافة الإلكترونات داخل البلورة. وبناء على تلك الكثافة الإلكترونية، تُعرَف المواقع متوسط حسابي للذرات داخل البلورة، إضافة إلى روابطها الكيميائية واعتلاجها ومعلومات أخرى.ولأنّ العديد من المواد تتبلور - مثل الأملاح والفلزات والمعادن وأشباه الموصلات والعديد من الجزيئات الحيوية والعضوية واللاعضوية - لعبت دراسة البلورات بالأشعة السينية دوراً أساسياً في تطوير مجالات علمية عدّة. في أوّل عقود انتشارها، حدّد هذا الأسلوب حجم الذرات، وأنواع الروابط الكيميائية وطولها، والفوارق بين مواد عديدة على المستوى الذري - خصوصاً المعادن والسبائك.
كما كشفت هذه التقنية عنْ الهياكل الداخلية والأدوار التي تلعبها العديد من الجزيئات الحيوية، بما في ذلك الحيمينات والأدوية والبروتينات والأحماض الننوية كالدنا. ولا يزال الأسلوب الرئيس لتوصيف التركيبة الذرية للمواد الجديدة وتصنيف المواد التي تبدو متشابهة في تجارب أخرى. البنية البلورية يمكنها أن توضّح السبب وراء خواص إلكترونية أو مرونية غريبة لمادة ما، وتلقي الضوء على التآثرات والعمليات الكيميائية، وتشكّل الأساس لتصميم الأدوية.
علم البلورات
تتبلور الأملاح والمعادن في أشكال بلورية مختلفة ، منها :
- نظام بلوري مكعب : مثل الحديد و النحاس و الفضة و ملح الطعام
- نظام بلوري رباعي
- نظام بلوري ثلاثي
- نظام بلوري ثلاثي الميل
- نظام بلوري أحادي الميل
- نظام بلوري معيني مستقيم
- نظام بلوري سداسي ، مثل الجرافيت.
طرق تعيين البناء البلوري/
الدراسات التي تقوم بتعيين البناء البلوري للأملاح والمعادن تعتمد على طرق القياس الآتية:
كما يمكن تعيين البناء البلوري المغناطيسي بواسطة حيود النيوترونات
أنواع التبلور
توجدالمادة الصلبة في إحدى من ثلاثة تصنيفات بالنسبة إلى بنيتها البلورية ، هي :
- بلورة أحادية ،
- كثيرة البلورات ،
- مادة لابلورية.
بلورة أحادية
بلورة أحادية(بالإنجليزية:single crystal ) هي مادة صلبة تتميز بامتداد الشبكة البلورية فيها من أولها إلى آخرها مكونة بلورة كبيرة منتظمة . وتتكون البلورة الأحادية مثلا عن طريق تغطيس بلورة صغيرة في محلول مشبع بمادة البلورة ، وتكون البلورة الصغيرة بمثابة بذرة تتراص عليها الذرات أو الجزيئات ، وتأخذ كل ذرة من ذرات المذاب موضعها بالضبط في الشبكة البلورية وبذلك تنمو البذرة إلى بلورة أحادية كبيرة .
كثيرة البلورات
كثيرة البلورات (بالإنجليزية: Polycrystalline) هي مواد مكونة من حبيبات بلورية كثيرة لها أحجام مختلفة وعشوائية التوزيع . يمكن عن طريق ضبط عملية التبلور التوصل إلى تقليل عشوائية التوزيع بحيث تنتظم البنية البلورية ونحصل على ما يسمى بلورة أحادية.
- تبين الصورة المجاورة تكون الحديد الصلب من حبيبات ، تشكل كل منها بلورة أحادية تتبع النظام البلوري الخاص بالحديد ، وتتوزع فيه البلورات الأحادية توزيعا عشوائيا بالنسبة للاتجاه .
مادة لابلورية
الثلاثاء، 5 فبراير 2013
كيف يعمل الصابون على تنظيف الملابس .؟

جزيئات الصابون تحتوي على سلسلة هيدروكربونية ( طرف هيدروكربوني ) وطرفها الآخر يحمل شحنات سالبة تعادلها شحنات موجبة ( الطرف الأيوني ) .
إن وجود الطرف الأيوني في الجزيئات يجعل الصابون قادراً على الذوبان في الماء إلى حد ما ، فإذا وضع الجسم الملوث بالدهون في محلول الصابون فإن الجزء الهيدروكربوني يعمل على إذابة الأوساخ الدهنية والجزء الأيوني يساعد على الإذابة في الماء ، وكأن جزىء الصابون يعمل كملقط يمسك بالدقائق الدهنية الملوثة للملابس والأواني ويدخلها في الماء .
كما أن الصابون يعمل أيضاً على عزل المواد الملوثة عن بعضها وعن الجسم الملوث وبذلك تزول الأوساخ .
تحيتي ...,،~
الموضوع الأصلى: http://www.sef.ps/vb/multka254036/#ixzz2K2mNLkYh

جزيئات الصابون تحتوي على سلسلة هيدروكربونية ( طرف هيدروكربوني ) وطرفها الآخر يحمل شحنات سالبة تعادلها شحنات موجبة ( الطرف الأيوني ) .
إن وجود الطرف الأيوني في الجزيئات يجعل الصابون قادراً على الذوبان في الماء إلى حد ما ، فإذا وضع الجسم الملوث بالدهون في محلول الصابون فإن الجزء الهيدروكربوني يعمل على إذابة الأوساخ الدهنية والجزء الأيوني يساعد على الإذابة في الماء ، وكأن جزىء الصابون يعمل كملقط يمسك بالدقائق الدهنية الملوثة للملابس والأواني ويدخلها في الماء .
كما أن الصابون يعمل أيضاً على عزل المواد الملوثة عن بعضها وعن الجسم الملوث وبذلك تزول الأوساخ .
تحيتي ...,،~
الموضوع الأصلى: http://www.sef.ps/vb/multka254036/#ixzz2K2mNLkYh
تفاعل ايونات الملح في الماء( التميه)
بشكل عام درجة حموضة المحلول الملحي تعتمد على قوة الحمض وقوة القاعدة التي تكون منها الملح اصلا وعليه:-1-الملح الذي يتكون من حمض قوي وقاعدة قوية يكون محلوله متعادلا مثل NaCL.KCl وتكون قيمة PH للمحلول الملحي تساوي 7
2- الملح الذي يتكون من حمض قوي وقاعدة ضعيفة مثل NH4CL يكون محلوله حمضي وقيمة PH لمحلوله اقل من 7
3- الملح الذي يتكون من قاعدة قوية وحمض ضعيف مثل NaCN يكون محلوله قاعدي وقيمة PH لمحلوله تكون اكبر من 7
4- الملح الذي يتكون من قاعدة ضعيفة وحمض ضعيف مثل NH4CN فان قيمة PH وطبيعة محلوله تعتمد على قيمة Ka وقيمة kb كما يلي :-
الموضوع الأصلى: http://www.sef.ps/vb/multka168577/#ixzz2K2kt1SwC
بشكل عام درجة حموضة المحلول الملحي تعتمد على قوة الحمض وقوة القاعدة التي تكون منها الملح اصلا وعليه:-1-الملح الذي يتكون من حمض قوي وقاعدة قوية يكون محلوله متعادلا مثل NaCL.KCl وتكون قيمة PH للمحلول الملحي تساوي 7
2- الملح الذي يتكون من حمض قوي وقاعدة ضعيفة مثل NH4CL يكون محلوله حمضي وقيمة PH لمحلوله اقل من 7
3- الملح الذي يتكون من قاعدة قوية وحمض ضعيف مثل NaCN يكون محلوله قاعدي وقيمة PH لمحلوله تكون اكبر من 7
4- الملح الذي يتكون من قاعدة ضعيفة وحمض ضعيف مثل NH4CN فان قيمة PH وطبيعة محلوله تعتمد على قيمة Ka وقيمة kb كما يلي :-
الموضوع الأصلى: http://www.sef.ps/vb/multka168577/#ixzz2K2kt1SwC
ا- اذا كانت ka اكبر من قيمة kb يكون المحلول حمضي اي PH اقل من 7
ب- اذا كانت قيمة Kb اكبر من Ka يكون المحلول قاعدي وقيمة PH اكبر من 7
ج- اذا كانت قيمة Ka = Kb يكون المحلول متعادل وقيمة PH له تساوي 7
مع التذكير بان تفاعل حمض مع قاعدة ينتج عنه ملح وماء
الموضوع الأصلى: http://www.sef.ps/vb/multka168577/#ixzz2K2lAUczU
ب- اذا كانت قيمة Kb اكبر من Ka يكون المحلول قاعدي وقيمة PH اكبر من 7
ج- اذا كانت قيمة Ka = Kb يكون المحلول متعادل وقيمة PH له تساوي 7
مع التذكير بان تفاعل حمض مع قاعدة ينتج عنه ملح وماء
الموضوع الأصلى: http://www.sef.ps/vb/multka168577/#ixzz2K2lAUczU
1. أنواع الليزر أنواع الليزر
يصنف الليزر تبعاً لنوع مادة الوسط الفعال فيها ، فبعض أنواع الليزر تتميز بكبر القدرة الناتجة عنها مثل ( ليزر ثاني أكسيد الكربون ) الذي يعتبر من أخطر أنواع الليزر ، بسبب قدرته العالية التي تصل إلى عشرات الكيلو واط ، وهذه القدرة الكبيرة أوحت بتسميته بأشعة الموت ، ويستخدم لقطع المعادن وفي تطبيقات صناعية مختلفة . كما توجد أنواع أخرى من الليزر ضعيفة جداً ، مثل تلك التي تستخدم في الحياة اليومية في المؤشرات ، وهذه عادة تكون ليزر ثنائي الوصلة .
وفيما يلي دراسة مفصلة لأهم أنواع الليزر :
1) ليزر الحالة الصلبة ( Solid-state laser )
وفي هذه الحالة تتوزع مادة الليزر في مصفوفة صلبة مثل ليزر الياقوت ( Ruby laser) وليزر النيوديميوم – ياج ( neodymium –Yag) .
2
1) ليزر الحالة الصلبة ( Solid-state laser )
ليزر الياقوت
صُنع أول جهاز ليزر بنجاح في عام 1960 وقد كان ليزر الياقوت . والياقوت بلورة لونها أحمر تتكون من أوكسيد الألومينوم ( Al2O3 ) المطعمة بأيونات الكروم الثلاثية (Cr 3+ ) .
وتكون أيونات الكروم هي المسؤولة عن توليد مستويات طاقة جديدة داخل التركيب البلوري وتكون مؤثرة أيضاً في عمليات الانتقال المصحوبة بتوليد الليزر .
ويتم في أنبوب توليد الليزر استخدام بلورة بشكل اسطوانة وتقطع نهايتيها المتقابلتين وتُطليان بالفضة ليتكون مرآتان من نفس المادة وتشكل هاتين النهاتين مرآتين إحداهما عاكسة كلياً والأخرى عاكسة جزيئاً .
ويستخدم مصباح ومضي لولبي ليحيط بالياقوت ، وعندما يبعث المصباح وميضاً عالي الشدة فإن أيونات الكروم تمتص الضوء الصادر ويرتفع عدد كبير من هذه الأيونات إلى مستويات الطاقة العليا . وعند هبوطها إلى مستوى الحالة شبه المستقرة يتحقق شرط التوزيع المعكوس ويتولد شعاع الليزر عند هبوطها إلى مستوى الطاقة الأول ( Ground state ) . تكون أشعة الليزر الناتجة هنا ذات لون أحمر طولها الموجي 694 ناتومتر .
ليزر النيوديميوم – ياج :
يعد هذا الليزر من أهم أنواع الليزر الموجودة حالياً ، ويتفوق على ليزر الياقوت بكثير من المزايا ، وكلمة الياج هي مختصر لمادة بلورية هي ( Y3 AL5 Q2) ( YttriumAluminum Garnet ) وتطعم هذه البلورة بأيونات النيوديميوم (Nd3+ ) بنسبة 2.5% حيث تحل هذه البلورة محل أيونات الاتريوم الموجودة في الياج .
) ليزر الحالة الغازية ( Gas lasers )
ومن أهم أنواع هذا الليزر هو ليزر الهيليوم – نيون – (Helium Neon laser ) وليزر ثاني أكسيد الكربون( CO2 )
ومن أهم أنواع هذا الليزر هو ليزر الهيليوم – نيون – (Helium Neon laser ) وليزر ثاني أكسيد الكربون( CO2 )
ليزر الهيليوم – نيون :
ويتكون وسط الليزر هنا من خليط من غاز النيون وغاز الهيليوم 1 : 10 . ويوضع الخليط في أنبوبة مغلقة مفرغة .
تتم عملية الضخ باستخدام عملية تفريغ كهربائي ( فرق جهد عال يسلَّط بين الكاتود والأنود ) .
وتقوم الإلكترونات الناتجة عن مرور التيار بوساطة التفريغ الكهربائي بالتصادم مع ذرات الهيليوم حيث تنقلها إلى مستويات الطاقة العليا ، ثم بتصادم ذرات الهيليوم مع ذرات النيون يمكن أن تنتقل الطاقة إلى ذرات النيون والتي تنتقل بدورها من مستوى الطاقة الأول إلى مستوى طاقة أعلى ( طا3 ) .
وبهذا يتم تحقيق التوزيع المعكوس لذرات النيون . وعندئذ يحدث الانبعاث المستثار إلى مستوى الطاقة ( طا3 ) لذرة النيون لتنتقل الذرة إلى المستوى ( طا2 ) باعثة حزمة الليزر ذات اللون الأحمر بطول موجي 633 نانومتر . وتعتبر كفاءة هذا الليزر منخفضة جداً ، ولا تتعدى أعلى قدرة له ( 50 ملي واط ) . لكن استخداماته واسعة جداً بسبب طوله الموجي المرئي وانفراجيته الصغيرة .
ليزر ثاني أكسيد الكربون ( CO2 – laser )
يعتبر ليزر ثاني أكسيد الكربون من أهم أنواع الليزر ، بسبب كفاءته العالية التي تبلغ 30 % وكبر القدرة الناتجة عنه بسبب أن هذا الليزر يصدر إشعاعاً في منطقة الأشعة تحت الحمراء ومنطقة الميكرويف . وبسبب الحرارة العالية الصادرة عن هذا الليزر فإنه يصهر كل شيء يعترضه .
) ليزر الحالة السائلة ( Dye – lasers )
وتستخدم هذه الليزر بعض الصبغات العضوية المعقدة ، مثل استخدام الرودمين 6ج (Rhodamine G6 ) في محلول سائل كوسط لليزر ، وتتميز هذه الليزر بأننا يمكن الحصول منها على مدى واسع من الأطوال الموجية
4) الليزر شبه الموصل ( Semiconductor or diode – lasers )
يختلف الليزر شبه الموصل عن ليزر الحالة الصلبة في طريقة تمثيل مستويات الطاقة ، وبالتالي ميكانيكية الضخ وعملية الانبعاث الضوئي ، حيث يحتوي ليزر شبه الموصل على حزم عريضة من مستويات الطاقة بدلاً من المستويات المفردة التي تحدث بينها الانتقالات التي تشارك في عملية انبعاث الليزر . وكل حزمة من هذه الحزم تحتوي على عدد كبير من مستويات الطاقة المتقاربة والتي لا يقترن وجودها بذرات معينة وإنما تشترك فيها المادة البلورية كلها .
إن ليزر شبه الموصل عبارة عن وصلة ثنائية (P-N junction ) وأكثر أنواعه شيوعاً هو زرنخيد الجاليوم (Ga As ) وشعاع الليزر الذي يبعثه يقع في منطقة تحت الحمراء وهو ضوء غير مرئي .
5) الإكسايمر ( Excimer lasers )
والاسم بالانجليزية مشتق من excited ( المثارة ) و dimmers ( الضوء القصير المدى ) .
ويستخدم هذا النوع خليط من غازات غير خاملة مثل الكلور والفلور ، وغازات خاملة مثل الآرجون ، الكربتون ، والزينون . وباستخدام التفريغ الكهربائي يمكن إنتاج جزيء وهمي يصدر ضوءاً قصير المدى ويكون الطول الموجي المميز له في منطقة الضوء فوق البنفسجي .
والجدول التالي يوضح بعض أنواع الليزر والطول الموجي لشعاع الليزر الناتج :
نوع الليزر منطقة الإشعاع الطول الموجي ( نانومتر )
آرجون ـ فلور فوق البنفسجي 193
كربتون ـ فلور فوق البنفسجي 248
النيتروجين فوق البنفسجي 337
الآرجون الأزرق 448
الآرجون الأخضر 514
الهيليوم ـ نيون الأخضر 543
الهيليوم ـ نيون الأحمر 733
الرودمين ج 6 متغير 570 ـ 650
نيوديميوم ـ ياج تحت الحمراء القريبة 1064
ثاني أكسيد الكربون تحت الحمراء البعيدة 10600
الموضوع الأصلى: http://www.sef.ps/vb/multka265180/#ixzz2K2jjwC8P
الاثنين، 4 فبراير 2013
من العوامل التي تعتمد عليها الذائبية هي طبيعة المذاب والمذيب ...الكتلة المولية لها دور كبير في الذائبية وذلك عند مقارنة نفس نوع المركبات مع بعضها مثل ذائبية الايثانول CH3CH2OH والهكسانول CH3CH2CH2CH2CH2CH2OH في الماء فان ذائبية الهكسانول في الماء قليلة مقارنة مع الايئانول لان الكتلة المولية للهكسانول اكبر وهنالك عامل اخر تعتمد عليه ذائبية المواذ وهو التركيب الجزيئي واوضح ذلك بمثال لو اخذنا الميثانول CH3OHوالماءHOH و البروبانCH3CH2CH3 , نلاحظ ان التركيب الجزيئي للماء والميثانول متشابه في مجموعة الهيدروكسيلOH ولهذا فانهما يذوبان معا بسهولة .وكذلك بالنسبة للبروبا والميثانول فانه يوجد بينهما تركيب مشترك وهو المجموعة الالكيلية CH3ولهذا يذوبان معا , اما بالنسبة للماء والبروبان فلا يذوبان معا لانه لا يوجد تركيب مشترك بينهما هذا هو المقصود بالتركيب الجزيئي .
اضيف شئ مهم عن الذائبية للمواذ وهو القطبية اي ان المركبات المتشابهة في القطبية تذوب معا .والمواد المختلفة في القطبية لا تذوب وهذا الموضوع مهم جدا في عملية الذوبان ولكن لا يشرح من جميع المعلمين وانا انصح جميع المعلمين بشرح مفهوم القطبية لانه سيوضح للطالب عملية ذوبان المواد مع بعضها .
الموضوع الأصلى: http://www.sef.ps/vb/multka442121/#ixzz2Jx2rPCQ7
اضيف شئ مهم عن الذائبية للمواذ وهو القطبية اي ان المركبات المتشابهة في القطبية تذوب معا .والمواد المختلفة في القطبية لا تذوب وهذا الموضوع مهم جدا في عملية الذوبان ولكن لا يشرح من جميع المعلمين وانا انصح جميع المعلمين بشرح مفهوم القطبية لانه سيوضح للطالب عملية ذوبان المواد مع بعضها .
الموضوع الأصلى: http://www.sef.ps/vb/multka442121/#ixzz2Jx2rPCQ7
اذابة الامونيا في الماء...المادة التي تكون بعد كلمة في هي المذيب وهنا الماء يكون مذيب وهو سائل والامونيا مذاب وهي غاز فالمحلول هنا غاز في سائل ..وعليه تكون حالة المحلول من حالة المذيب( اي الماء )حيث تكون حالة المحلول في هذا المثال سائل
الموضوع الأصلى: http://www.sef.ps/vb/multka442121/#ixzz2Jx1pm8qr
الموضوع الأصلى: http://www.sef.ps/vb/multka442121/#ixzz2Jx1pm8qr
في قاعدة تقول ان حالة المحلول تكون من حالة المذيب ..يعني اذا قلنا اذابة السكر في الماء يعني المذاب هو السكر والمذيب هو الماء اي صلب في سائل ...وعليه تكون حالة المحلول سائل
الموضوع الأصلى: http://www.sef.ps/vb/multka442121/#ixzz2Jx1QZN8D
الموضوع الأصلى: http://www.sef.ps/vb/multka442121/#ixzz2Jx1QZN8D
الغيوم تتكون من بخار الماء في الهواء ولذلك يكون المذاب سائل وهو قطرات الماء والمذيب هو الهواء وحالته غازية ...ولازم تعرف ان حالة المحلول تكون من حالة المذيب وعليه تكون حالة المحلول غاز ....
الموضوع الأصلى: http://www.sef.ps/vb/multka442121/#ixzz2Jx0rQhcG
الموضوع الأصلى: http://www.sef.ps/vb/multka442121/#ixzz2Jx0rQhcG
الاشتراك في:
الرسائل (Atom)